时间: 2024-01-09 20:16:28 | 作者: 特种活性剂
3月5日傍晚,新华社发布《中央国务院关于深化医疗保障制度改革的意见》,立即引起政府、市场的巨大反响。《意见》虽从深化医保改革入手,却深入涉及整个“三医联动”改革,被各界一致认为是能够为未来十年中国医改定调的纲领性文件。《意见》共28条,整体框架可概括为“1+4+2”。
“1”,是指整体目标——“力争到2030年,全面建成以基本医疗保险为主体,医疗救助为托底,补充医疗保险、商业健康保险、慈善捐赠、医疗互助一起发展的多层次医疗保障制度体系”。医改的人说,此条既是目标,也是总纲,确定了中国医保制度定位。
“4”,是指“健全待遇保障、筹资运行、医保支付、基金监管四个机制”。这是下一步医保改革的四大领域。
“2”,是指完善医药服务供给和医疗保障服务两个支撑。这再次表明,国家医保局成立以来,虽改革力度极大,但单兵突进,势必后继乏力,必须联合卫健、药监等部门齐心合力,联动医药、医疗两项改革,方能持续、长远发展。
3月2日,国家医保局联合国家卫健委下发《关于推进新型冠状病毒肺炎疫情防控期间开展“互联网+”医保服务的指导意见》(以下简称“意见”)。文件重点涉及将合乎条件的“互联网+”医疗服务费用纳入医保支付范围;鼓励定点医药机构提供“不见面”购药服务;完善经办服务等6条指导意见。该意见印发是贯彻落实党中央、国务院疫情防控统一部署,积极打通互联网医疗的医保支付通道,有利于减少群众就医购药时的交叉感染风险,享受在线医保结算的便捷服务。分析人士指出,此次6条指导意见的出台,有望推动互联网医疗纳入医保在全国范围内的“遍地开花”。在相关解读文件中,国家医保局表示,将会同国家卫健委重视指导、及时总结各地的做法,将更多合乎条件的“互联网+”医疗服务纳入医保支付范围,支持定点医药机构提供“不见面”就医购药服务。在特殊时期,互联网+医疗服务的作用会被进一步放大,各地经验无疑会加速这个产业向纵深发展。

2020年03月02日,国家药品监督管理局发布了《药品上市许可持有人检查工作程序(征求意见稿)》《药品上市许可持有人检查要点(征求意见稿)》,参考这两个征求意见稿,意见稿提到了药品上市许可持有人应建立的四大体系三十六项文件。
3月4日,国家卫健委医政医管局正式下发《新冠病毒肺炎诊疗方案(试行第七版)》。其中,磷酸氯喹用法用量调整,托珠单抗首次被推荐用于免疫治疗。在抗病毒治疗中,第七版将磷酸氯喹的用法用量进行了调整。第七版里提到,磷酸氯喹适用于18~65岁成人,体重大于50公斤者,每次500mg、每日2次,疗程7天;体重小于50公斤者,第一、二天每次500mg、每日2次,第三至第七天每次500mg、每日1次。而第六版中磷酸氯喹的使用上的要求是成人200mg,每日2次,疗程不超过10天。第七版诊疗方案在重型、危重型病例的治疗中增加了“托珠单抗”用于免疫治疗。适应证为“双肺广泛病变者及重型患者,且实验室检测IL-6水平升高者”。给出了具体用法、用量,要注意过敏反应,有结核等活动性感染者禁用。
3月2日,强生旗下西安杨森宣布,欧洲药品管理局(EMA)已授予其腺相关病毒(AAV)-色素性视网膜炎GTP酶调节剂(RPGR)基因疗法优先药物资格(PRIME)和前沿治疗药品(ATMP),用来医治遗传性视网膜疾病X连锁性色素性视网膜炎(XLRP)。这也是目前获得PRIME认证的唯一一个RPGR基因治疗项目,西安杨森将加快该疗法在欧洲上市的监管审查时间。
4日,据北京地坛医院官方微信消息,其收治的一例56岁新冠肺炎患者,通过基因测序证实脑脊液中存在SARS-CoV-2病毒,临床诊断为病毒性脑炎,患者中枢神经系统受病毒侵袭。目前来说,新冠肺炎患者可合并重度呼吸窘迫综合征(ARDS)、心肌损害、凝血功能异常、肾脏损伤、肝脏损害等多脏器损害,但尚未发现有中枢神经系统受累的报道,此病例报道在全球尚属首例。
国家卫生健康委医政医管局监察专员郭燕红8日在发布会上表示,在武汉,有一支感染控制的专家团队,他们有一项工作就是在每一支医疗队进入到工作岗位之前,专门对他们进行感染控制和防护工作培训,使他们可以做好防护,避免感染,最大限度降低感染风险。目前为止,4.2万医疗队无1人感染。
国家卫生健康委医药卫生科技发展研究中心主任郑忠伟在6日的国务院联防联控机制新闻发布会上说,目前新冠肺炎疫苗5条技术路线:灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、核酸疫苗稳步推进。估计到4月份,依照国家有关法律法规规定,部分疫苗有希望进入临床或者应急使用。新冠肺炎病毒毕竟是新病毒,研究认识有个过程,疫苗要在确保安全有效的前提下加快探索。
3月3日,全球科学服务的领导者赛默飞世尔科技联合全球领先分子诊断和样品制备技术提供商的QIAGEN宣布,双方董事会已一致通过,赛默飞以104亿欧元(约115.9亿美元),即每股39欧元现金收购QIAGEN的提议。该交易预计将于2021年上半年完成。

3月3日,贝达药业发布定增预案,本次非公开发行的发行对象为不超过35名符合中国证监会规定条件的特定对象,发行数量不超过1.2亿股,募资不超过10.02亿元,扣除发行费用后将用于新药研发及研发设备升级项目和补充流动资金。
近年来,随着自由基化学的蓬勃复兴,光氧化还原催化反应的研究也得到了迅猛的发展。相比于热反应中使用的催化剂,光氧化还原催化剂通常仅在激发状态下具有催化活性,通过与底物分子发生单电子转移(SET)实现催化过程。可见光引发的光反应无需使用紫外光等高能量光源,仅在可见光照射的温和条件下便可形成自由基物种,更好地避免其他副产物形成。卤代烃作为有机化学反应中重要的合成砌块在热反应催化体系中应用广泛,这类化合物一般可在过渡金属催化剂的作用下参与多种C-C键、C-X键的偶联过程。相比之下,由于卤代烃的还原电位负值较大(对于非活化的碘代烷烃及芳香烃,Ered -2 V vs SCE),需要借助强还原剂驱动SET,形成相应的碳自由基物种较为困难,因而很少用作光氧化还原催化反应的底物。最近,英国曼彻斯特大学(University of Manchester)的Fabio Juliá教授与Daniele Leonori教授合作,发现α-氨基烷基自由基可有效攫取卤代烃中的卤素原子,形成碳自由基活性物种,进而设计一系列光氧化还原催化反应。而α-氨基烷基自由基通过廉价易得的胺便可产生,其反应活性可与经典的自由基引发体系相媲美。相关研究工作发表在顶级学术期刊Science上。
近年来,关于肠道菌群的很多新研究让我们注意到,肥胖以及糖尿病、高血压、卒中等肥胖相关的问题,除了遗传因素外,背后往往还有肠道菌群在发挥作用。而根据最近发表在顶尖学术期刊《科学》上的一篇论文,肠道菌群对肥胖的影响还可以追溯到“娘胎”。日本的一支研究团队通过小鼠实验发现,母亲怀孕时的肠道菌群对胎儿日后的健康发育有长远的影响:当母亲肠道细菌的某些代谢产物不足,小鼠出生后很容易一吃就胖,并发展出代谢紊乱;而孕期补充膳食纤维,能够在一定程度上帮助孩子预防代谢相关疾病。

CAR-T上市申请拟纳入优先审评全球目前共有两款获批上市的 CAR-T 细胞免疫治疗产品,除 Yescarta,另一款是诺华的Kymriah,大多数都用在治疗儿童和年轻成人(2 至 25 岁)的急性淋巴细胞白血病及成年人复发/难治性大 B 细胞淋巴瘤(包括弥漫性大 B 细胞淋巴瘤、转化型滤泡性淋巴瘤和原发纵隔 B 细胞淋巴瘤)。根据吉利德和诺华已公布的财务报告数据显示,2019 年度,Yescarta、Kymriah全球销售额分别约为 4.56 亿美元、2.78 亿美元。
复星凯特是从 Kite Pharma 引进 Yescarta,获得其在中国大陆、香港特别行政区和澳门特别行政区的技术及商业化权利,并拟于中国境内(不包括港澳台地区)进行本地化生产。复星凯特于今年 2 月 24 日,提交上市申请获得国家药品监督管理局(NMPA)受理,此次上市申请是基于在中国开展的一项单臂、开放性、多中心桥接临床试验(FKC),在难治复发型弥漫性大 B 细胞淋巴瘤 (DLBCL) 中国患者中评估了本品的安全性和疗效。据复星公告显示,截至2020 年 1 月,复星凯特现阶段针对该产品累计研发投入约为人民币 47,400 万元。
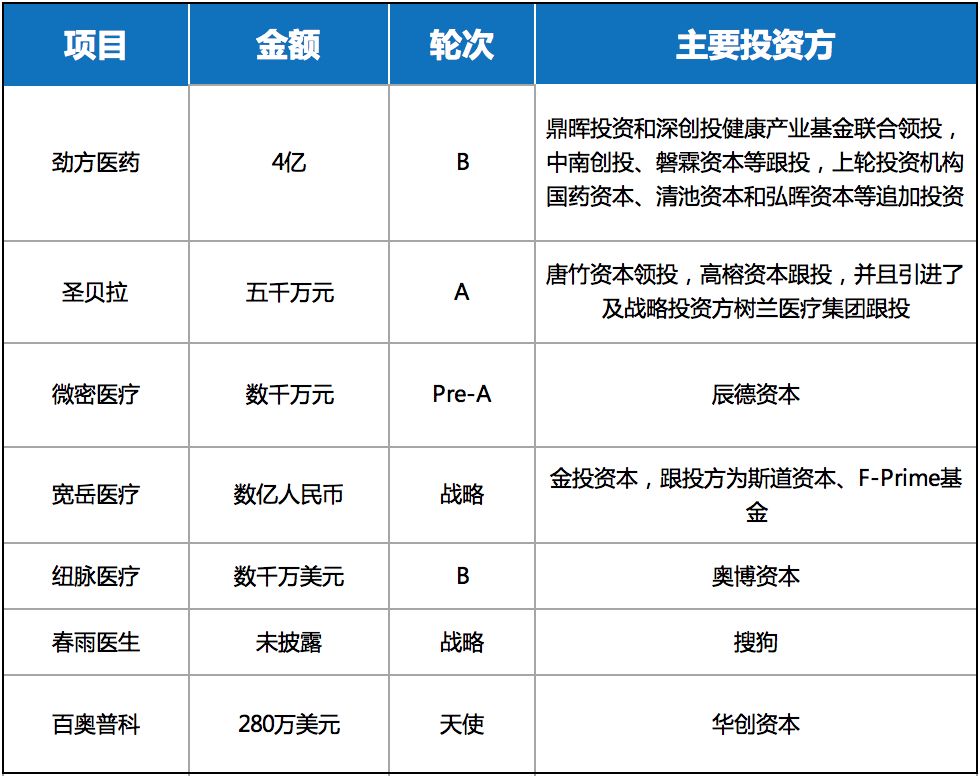
1亿块钱融资,加速培养基生产能力和CDMO服务平台扩建2020年3月9日,位于上海国际医学园区的上海奥浦迈生物科技有限公司宣布完成1亿元人民币新一轮融资,引进国寿大健康基金。此前,奥浦迈曾获得包括达晨财智和华兴医疗产业基金近亿元人民币战略投资。
奥浦迈由肖志华博士创立于2013年,拥有行业领先的无血清培养基 + CDMO一站式服务平台,致力于无血清培养基的国产替代,提供细胞系构建、工艺开发和中试等CDMO服务。本轮融资将加速奥浦迈培养基生产能力和CDMO服务平台的扩建,更好地引进人才和拓展国际业务。细胞培养基是生物制药不可或缺的原料,决定了产物的产量和质量,是生物药临床前开发成功的重要的条件,更是大规模生产中成本控制的重要环节。长期以来,国内培养基主要依赖进口,尤其在无血清培养基配方和工艺技术领域,容易受到国际形势和贸易政策的影响。奥浦迈的培养基价格低于进口品牌的1/2,且产品性能优越、质量稳定,超过30个正在临床申报的生物药项目使用奥浦迈的培养基和技术服务。
目前,奥浦迈的无血清培养基业务的90%集中在抗体市场,未来将积极布局细胞治疗培养基的开发及产业化。近年来,我国生物制药行业蒸蒸日上,奥浦迈创立至今已累计200多家知名客户,囊括药明康德、恒瑞医药、金赛药业、三生国健、国药集团、百济神州、华兰生物、东曜药业、岸迈生物、和铂生物、复旦大学等国内创新药企和科研院所。岸迈生物中美双报IND获批的双特异性抗体EMB01采用的是奥浦迈构建的细胞系,君实生物获FDA临床试验批准的全球首个抗BTLA单抗使用的是奥浦迈培养基,赴港IPO的东曜药业平台采纳奥浦迈培养基等等。

IPO3月6日,永泰生物制药有限公司再次向港交所递交招股书,拟在香港主板IPO上市,永泰生物有望成为第 14 家港股未盈利生物医药公司。
该公司此前于2019年9月2日向港交所递交招股书。永泰生物制药是国内一家专注于 T 细胞免疫治疗药物研发和商业化的生物医药公司。核心在研产品 EAL® 是中国唯一获准进入实体瘤治疗 II 期临床试验的免疫细胞产品,为预防早期肝癌复发及延长早期肝癌患者无复发生存期及总生存期。2018 年 9 月公司获批入组第一例 EAL 的 II 期临床试验患者。截至最后实际可行日期,EAL®II 期临床试验已入组患者 152 例。
尚未有主营收入,其部分收入主要来自于提供细胞冷冻保存服务、利息收入和补贴。其相应期间的研发开支分别为 3,117.2万、6,197.5 万元人民币,相应的净亏损分别为3,488.8 万元及 10,905.4 万元人民币。4、恒瑞
卡瑞利珠单抗第2个适应症即将获批,二线日,江苏恒瑞医药股份有限公司自主研发的PD-1抑制剂卡瑞利珠单抗(艾瑞卡®)正式获得国家药品监督管理局(NMPA)批准用于肝癌领域的治疗,这是中国首个获批肝癌适应症的PD-1抑制剂。获批适应症为接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。2019年5月,恒瑞PD-1卡瑞利珠单抗正式获得NMPA批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。卡瑞利珠单抗是国内第5个上市的PD-1单抗,同时也是第3个获批上市的国产PD-1单抗。随后,在2019年,恒瑞又有3个适应症申报上市,分别是肝细胞癌、非鳞非小细胞肺癌和食管鳞癌,这3个癌症均是国内发病率比较高的病种。
与此同时,卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期肝细胞癌的III期临床试验,已在中国、美国、欧洲同步启动,目前参与中心达29家。这项随机、对照、开放、国际多中心研究,是首例我国PD-1抑制剂在世界肝癌领域的探索,计划入组550例(中国350例,美国欧洲等地200例)患者并随机分为两组,一组使用卡瑞利珠单抗200 mg Q2W+阿帕替尼250 mg QD,另一组使用索拉非尼400 mg BID。研究的主要终点为OS和PFS。。
另一项卡瑞利珠单抗联合FOLFOX4系统化疗作为一线方案治疗晚期肝细胞癌的随机、开放标签、多中心III期研究也已开展。(资料来源:医药经济报)
平台声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。